مقدمه
امروزه اساسی ترین چالش در صنعت گاو شیری بکارگیری جیره هایی غنی از مواد مغذی در گاوهای شیری پرتولید، بدون مختل کردن اکوسیستم شکمبه، عملکرد و آسایش دام ها است. از طرفی راهکارهای مدرن تغذیه برای گاوهای شیری پرتولید از جیره های پرعلوفه به جیره های با درصد بالای کربوهیدرات های سریع التخمیر تغییر یافته که از جمله این تغییرات افزایش کنسانتره و سیلاژ ذرت (دارای بار اسیدیته بیشتر) و کاهش درصد فیبر جیره برای تامین نیاز دام به انرژی و حمایت از تولید شیر بیشتر میباشد. تخمیر مواد خوراکی در شکمبه، تولید اسیدهای چرب فرار (VFA) و لاکتیک اسید می کند که این اسید ها در صورت جذب یا خنثی نشدن موجب کاهش pH محیط شکمبه می شوند. اگر pH پایین در شکمبه برای ساعات طولانی از روز ادامه داشته باشد می تواند اثر منفی بر مصرف خوراک، متابولیسم میکروارگانیسم ها و تجزیه موادغذایی بگذارد. همچنین گزارشات حاکی از ارتباط کاهش pH شکمبه با عارضه هایی مانند التهاب سم، اسهال و کاهش میزان چربی شیر می باشد. اثرات اقتصادی این موارد حتی منجر به کاهش راندمان تولید مثلی و حذف اجباری دام می شود. گزارش شده ۱۰ تا ۴۰ % گله های گاو شیری به اسیدوز تحت حاد (SARA) دچار هستند (Kleen et al., 2009) به طوری که همه ساله بروز اسیدوز تحت بالینی ضررهای هنگفتی را بر صنعت گاو شیری وارد می نماید. اسیدهای تولید شده در طی تخمیر غلات، معمولا pH شکمبه را به طور جزئی زیر خنثی یا ۷ حفظ متمایل می کنند. اینکه pH تا چه اندازه ای زیر ۷ واحد باشد، بستگی به سرعت و مقدار اسید تولید شده، ترشح بزاق برای خنثی نمودن و یا جذب آنها از شکمبه دارد. از لحاظ تغذیه ای، مقدار و اندازه فیبر بر این پروسه دخالت دارد چراکه فعالیت جویدن و به دنبال آن ترشح بزاق، اثر مثبت بر تعدیل pH شکمبه خواهد داشت، در این رابطه مفهوم peNDF آورده شده که تاثیر معنی داری بر ترشح بزاق داشته اما در هنگام بررسی pH از طریق روش peNDF واریانس زیادی خواهیم داشت، شاید عیب این مفهوم مربوط به عدم توجه به شرایط متفاوت تخمیری و سوبستراهای غیر فیبری در شکمبه باشد (Dijkstra et al., 2012). در مطالعه متاآنالیز زبلی و همکاران (۲۰۰۸) مشخص شد با افزایش میزان peNDF به g/kg 310 ماده خشک جیره، pH شکمبه را به مقدار کفه ای ۶٫۲۷ افزایش داده و بعد از این مقدار، دیگر افزایش نخواهد داشت. بنابراین اگر بخواهیم pH شکمبه را به واسطه peNDF ثابت نگه داریم، مقدار آن را به نسبت مصرف ماده خشک و نشاسته تجزیه پذیر جیره متفاوت خواهد بود. با توجه به اهمیت موضوع pH شکمبه در گاو، ابتدا به بررسی مساله پرداخته شده و سپس راه های بهبود آن (صرف نظر از روش افزایش peNDF) مورد بحث قرار خواهد گرفت.
نمونه گیری pH و تشخیص SARA:
نمونه گیری از مایع شکمبه به روش های مختلفی از جمله کنوله و فیستوله گذاری، سرنگ، الکترود و سنسور فرستنده رادیویی انجام می گیرد. هر کدام از این روش ها مزایا و معایب خود را دارا هستند. به عنوان مثال کنوله گذاری دهانی و سرنگ استرس بالایی به گاو وارد می کند و یا اینکه در روش فیستوله گذاری نمونه گیری با فراوانی بالا کاری مشکل خواهد بود. از مزایای سیستم جاگذاری سنسور (indwelling systems) پاسخ خوب در نمونه گیری با فراوانی بالا و نزدیک بودن به اپیتلیوم شکمبه است اما به دلیل نیاز به کالیبره کردن مداوم و هزینه، روش رایجی نیست. با تمام این اوصاف pH شکمبه در ساعات مختلف روز و نواحی متفاوت از شکمبه تغییر می کند. یکی از نواحی استاندارد نمونه برداری، از کیسه شکمی (سمت کرانیال) است به خاطر اینکه بیشترین حرکات مخلوطی در آنجا اتفاق می افتد. مشخص شده pH در قسمت مرکزی شکمبه ۰٫۷۳ واحد کمتر از قسمت شکمی آن می باشد ((Colman et al., 2010. علاوه بر مکان و نحوه نمونه برداری، بررسی زمان یا ناحیه pH زیر محدوه خاص نیز حائز اهمیت است. زمانی که نمونه گیری در ۵ تا ۸ ساعت بعد از دادن TMR و یا ۲ تا ۵ ساعت بعد از دادن کنسانتره در خوراک دهی جداگانه انجام شود pH شکمبه در پایین ترین حد خود می باشد (Nocek, 1997). اندازه گیری زمانی که pH به ترتیب ۲۸۳ و ۴۷۵ دقیقه زیر pH 5.6 و ۵٫۸ باشد، راه مطمئنی برای تشخیص SARA میباشد (Colman et al., 2010). تشخیص SARA معمولا بوسیله بررسی pH مایع شکمبه بجای مایع نگاری است که بخاطر pH بالاتر نگاری به علت مخلوط شدن کامل با بزاق می باشد. اما ساتو و همکاران (۲۰۱۲) در مطالعه ای بر روی ۲ گروه گاو شاهد و تیمار محرک SARA دریافتند که اسیدوز تحت حاد(SARA) شکمبه را میتوان با اندازه گیری پیوسته نگاری نیز محاسبه نمود. اندازه گیری ها بوسیله pH سنج با فرستنده رادیویی انجام گرفت. مشاهدات نشان داد الگوی کاهشی pH در هر دو ناحیه شبیه هم بود اما شکمبه کاهش بیشتری نشان می داد که به علت رقیق شدن مایع نگاری با بزاق بود(جدول ۱). دیگر پارامتر های شکمبه با نگاری تفاوت معنی داری نداشت. در نتیجه همبستگی مثبت معنی دار بین pH شکمبه و نگاری در هر دو گروه گاوهای سالم و SARA وجود داشته و اندازه گیری پیوسته pH نگاری هم میتواند به تشخیص SARA کمک کند.
 جدول۱٫ تغییرات pH شکمبه و نگاری در گاوهای سالم با جیره شاهد و گاو های SARA با جیره محرک اسیدوز (Sato et al., 2012)
جدول۱٫ تغییرات pH شکمبه و نگاری در گاوهای سالم با جیره شاهد و گاو های SARA با جیره محرک اسیدوز (Sato et al., 2012)
آستانه pH شکمبه ای برای تشخیص SARA بوسیله روشهای نمونه بردای متفاوت ۵٫۵ (Duffield et al. 2004; Garrett et al. 1999) ، ۵٫۶ (AlZahal et al. 2007; Plaizier et al. 2009) و ۵٫۸ ((Nordlund and Garrett 1994 تعیین شده. مقادیر کمتر زمانی مورد استفاده دارد که مبنای تشخیص SARA در طرح آزمایشی خود، فقط یک عامل مثل کاهش pH مدنظر باشد اما اگر زمان و ناحیه زیر pH را هم در محاسباتمان قرار دادیم بهتر است مقادیر بالاتر را برای تشخیص استفاده کنیم (Aschenbach et al., 2011).
pH بحرانی برای کاهش تجزیه فیبر ۶٫۰ تا ۶٫۳ واحد می باشد (Erdman, 1988). بر اساس تغییر در جمعیت میکروبی و الگوی تخمیر، اولین آستانه pH 5.8 میباشد این آستانه همزمان با آستانه آسیب پذیری اپیتلیال شکمبه میباشد. دومین آستانه زیر pH 5 میباشد زمانی که پروتوزوئا ها از بین رفته و الگوی تخمیر به سمت افزایش تولید لاکتات میشود همزمان با آن، دومین آستانه آسیب به دیواره شکمبه هم اتفاق می افتد که باعث میشود اعمال انتقالی و جذب از دیواره به خطر بیافتد (Aschenbach et al., 2011).
بر هم خوردن تعادل pH :
جیره های سریع التخمیر در شکمبه توسط میکروارگانیسم ها طی فرآیند تخمیر، به اسید های آلی مثل اسید لاکتیک و اسید های چرب کوتاه زنجیر (SCFA) تبدیل می شوند. در ادامه درجه حرارت شکمبه افزایش یافته و اگر این اسید حبس شود PH شکمبه کاهش می یابد و از رشد میکروبها مخصوصا میکروب های هضم کننده فیبر، جلوگیری می کند. بر اساس متاآنالیز لانک و همکاران (۲۰۰۹) مشخص شد بر اثر افزایش مصرف روزانه ۱ g/(kg of BW) ماده آلی تخمیرپذیر، mmol/(kg of BW) 5.93 افزایش تولید SCFA را خواهیم داشت. اگرچه هر SCFA میتواند بر اثر تفکیک، یک H+ تولید کند اما بسته به نوع SCFA تولید شده در پروسه تخمیر مقادیر اسید تولیدی به ازای هر هگزوز متفاوت است. مثلا تخمیر گلوکز موجب تولید ۲ مول استات، ۲ مول پروپیونات و ۱ مول بوتیرات میشود. بنابراین اگر مقدار بوتیرات کمتری تولید شود بار اسیدی نیز کمتر خواهد بود. از طرفی می توان با افزایش بوتیرات pH شکمبه را بهبود بخشید و از کاهش آن جلوگیری نمود، چراکه این VFA دارای خاصیت مایتوژنیک بر اپیتلیوم شکمبه است به عبارتی باعث توسعه پرزهای شکمبه میشود. در نتیجه جذب اسید از دیواره را افزایش داده. تولید اسیدهای آلی خصوصا SCFA نتیجه دلخواه ما از تخمیر است اما تولید پروتن ها از اسیدهای ضعیف فرآیندی ناخواسته است. نکته جالب این است که خود SCFA به عنوان بافر عمل میکنند یعنی زمانی که pH بالاست پروتن آزاد میکنند و مشکل این است که آنها pH حدود ۴٫۸ را بافری میکنند. حالت بدتر زمانی است که لاکتات هم به این سیستم بافری می پیوندد و باعث کاهش pKa ۱ واحد پایین تر از سیستم بافری SCFA می شود. اولین نشانه برهم خوردن تعادل pH شکمبه اسیدوز تحت حاد شکمبه ای (SARA) می باشد. البته در زمان SARA غلظت لاکتات پایین است اما زمانی که PH شکمبه پایین تر از ۵٫۷ می رسد غلظت لاکتات نیز افزایش می یابد (Dijkstra et al., 2012). در ادامه این روند، گزارش شده تجمع ≥۵ mmol/L لاکتات، آستانه ایجاد اسیدوز حاد می باشد (Nocek, 1997). اسیدلاکتیک یک اسید قوی تر (pKa=3.86) نسبت به پروپیونات (pKa=4.87)، استات (pKa=4.76) یا بوتیرات (pKa=4.82) میباشد. این اسیدها از اپیتلیال شکمبه جذب میشوند، ولی لاکتات به خاطر pKa پایینتر، کند تر از دیگر VFA ها از شکمبه جذب میشود. افزایش غلظت اسید لاکتیک موجب کاهش pH شکمبه، کاهش تکثیر باکتری های سلولاتیک و هضم فیبر می شود. نرخ عبور مایع شکمبه در غلظت لاکتات نیز موثر است به طوری که با افزایش نرخ مایع شکمبه درصد لاکتات از کل اسیدهای آلی کاهش یافته است (AbuGhazaleh et al., 2005). اما این مکانیسم تاثیر ناچیزی بر تنظیم غلظت لاکتات داشته است. بنابراین بر اثر تجمع لاکتات، میزان پروتن ها نیز در محیط شکمبه افزایش می یابد. بخشی از آنها توسط بافر های بزاق خنثی میشوند برخی نیز از دیواره شکمبه جذب خواهند شد اما در صورتی که تولید اسید بیش از ظرفیت جذب یا خنثی شدن باشد، pH شکمبه افت خواهد کرد. میتوان با بکار بردن بافرها اثر منفی افت pH را، به طور محدود برطرف نمود ولی از آنجایی که تنها عامل pH در این شرایط دخیل نیست، باید به فکر راه های دیگر باشیم. به عنوان مثال کنترل جمعیت باکتریایی خصوصا Streptococcus bovis که از تولید کنندگان اصلی اسید لاکتیک است. در این باره در بخش “بهبود pH شکمبه” به مفصل بحث خواهد شد .
جذب SCFA و تنظیم pH:
در رابطه با تنظیم pH جذب اسید ها از شکمبه بیشتر از عبورآنها مد نظر است. به طور کلی در گاو شیری ۰٫۲۰ تا ۰٫۴۰ از کل VFA های تولید شده در شکمبه، به نواحی بعدی لوله گوارش عبور می کنند، این مقادیر بر اثر میزان دریافت خوراک و ترکیب غذا متغیر است به عنوان مثال با افزایش مصرف خوراک یا میزان فیبر جیره می توان نرخ عبور فاز مایع را افزایش داد. از طرفی در pH ۶، تنها ۰٫۰۶ از SCFA غیر یونیزه (undissociated VFA یا VFA های پروتنه) عبور خواهند کرد (Dijkstra et al., 2012). بنابراین میزان جذب از دیواره شکمبه عاملی است که علاوه بر تنظیم مقدار VFA عبوری، می تواند پروتن ها را از محیط شکمبه خارج کند. ۳ مکانیسم در جذب اسید از اپیتلیوم مشخص شده ۱٫ جذب VFA پروتنه به صورت انتشار ساده چربی دوست ۲٫ جذب وابسته به بیکربنات ۳٫ جذب مستقل از بیکربنات(شکل ۱).
استات، پروپیونات و بوتیرات بوسیله مکانیسم انتقال با بیکربنات جذب میشود. این انتقال به طول زنجیره چربی ها و pH محیط وابسته است به طوری که افزایش جذب VFA ها متفاوت می باشد (butyric acid > propionic acid > acetic acid). وابستگی به pH از جنبه افزایش پروتن در محیط و اتصال با VFA می باشد. اگرچه اپیتلیوم شکمبه بخش بزرگی از پروتن های شکمبه را جذب می کند، با این حال میزان پروتن ها توسط پمپ سدیم-هیدروژن (عمل آن برای حفظ استحکام سلول است) داخل شکمبه ریسایکل می شود. این ریسایکل نیز با افزایش انتقال VFA غیر یونیزه و نیز منبع سدیم ورودی به شکمبه افزایش می یابد. جذب VFA یونیزه شده(آنیونی) نیاز به کانال های پروتئینی و انرژی دارد. برای حفظ شیب آنیونی در هنگام جذب VFA یونیزه، باید ترشح آنیون یا جذب کاتیون به داخل شکمبه بیشتر شود. نمونه این فرآیند، مکانیسم بیکربنات-آنیون است. دیواره شکمبه منبعی برای ترشح بیکربنات گرفته شده از خون یا تجدید سنتز آن (de novo) میباشد. این مکانیسم می تواند pH شکمبه را نیز تعدیل نماید (Dijkstra et al., 2012). مکانیسم جذب VFA یونیزه از طریق کانال های مستقل از بیکربنات نیز تاثر منفی بر pH گذاشته به طوری که بر اثر جذب VFA، پروتن ها را بدون خنثی سازی به داخل شکمبه آزاد کرده(شکل ۱ قسمت شماره ۴).
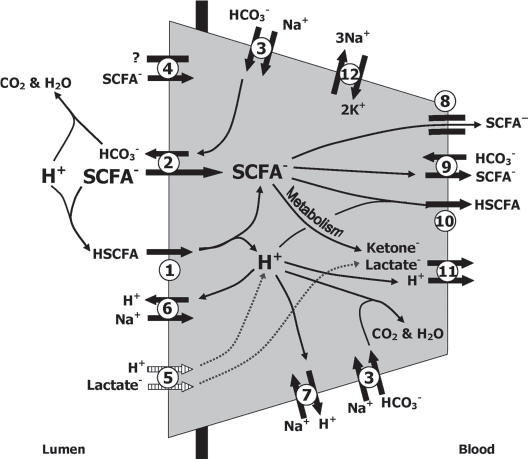 شکل۱ مدل جذب اسید های آلی از دیواره شکمبه به خون (Aschenbach et al., 2011).
شکل۱ مدل جذب اسید های آلی از دیواره شکمبه به خون (Aschenbach et al., 2011).
۱٫انتشار چربی دوست SCFA غیر یونیزه، یکی از راه های کارآمد جذب SCFA با میل جذبی بالا همچون بوتیرات می باشد. این اسید چرب بلافاصله بعد از ورود به سلول پروتن خود را آزاد کرده. ۲٫هر ۳ VFA مهم می توانند از طریق پروتئین های غشا بوسیله آنتی پورت فرم آنیونی خود با بیکربنات وارد سلول شوند (این حالت معمولا برای اسیدهای چرب با میل جذبی کم مثل استات کارامد تر است)۳٫ بیکربنات می تواند از طریق سیم پروت با سدیم از خون جذب سلول شود، خروج بیکربنات از سلول به شکمبه منجر به خنثی نمودن یک پروتن از شکمبه می شود ۴٫آنیون استات بوسیله پروتئین هایی از دیواره مستقیما جذب شده (مکانیسم انتقال نا مشخص) ۵٫آنیون لاکتات همراه به پروتنش وارد سلول شده (این مکانیسم بسیار آهسته است)، پروتن وارد شده یا بوسیله مکانیسم ۳ خنثی شده یا بوسیله آنتی پورت با سدیم به شکمبه بازگردد (۶ و ۷). SCFA موجود در سلول بوسیله کانال های پروتئینی(۸) یا آنتی پرت با بیکربنات (۹) و یا به صورت پروتنه مستقیما از غشا سلول به خون به صورت انتشار چربی دوست منتقل شود(۱۰). درون سلول بوتیرات به مقادیر وسیعی کتون بادی متابولیزه شده و بخشی از پروپیونات نیز به لاکتات متابولیزه شده که هر دو بوسیله مونوکربوکسیلات ترانسپورتر از سول به خون دفع می شوند(۱۱). تمامی انتقالات سدیمی بوسیله پمپ Na-K ATPase تنظیم شده(۱۲)
اثر متقابل آمونیا (متشکل از NH3 و NH4⁺) و SCFA :
جذب SCFA، انتقال اوره به داخل شکمبه را شتاب بخشیده. این کار از طریق ریسایکل کردن آمونیوم و جذب پروتن ها از شکمبه به خون می باشد ( کمک به افزایش pH شکمبه). در شکمبه روزانه ۲۵ مول آمونیوم جذب و به دنبال آن ۱۰ مول اوره به شکمبه ترشح می شود (Aschenbach et al., 2011). مشخص شده ۹۰% اوره در گردش بدن گاو، می تواند به لوله گوارش (gut) ریسایکل شده که سهم بزرگی از آن نیز به شکمبه باز می گردد (Reynolds and Kristensen, 2008). اوره به محض ورود به شکمبه توسط اورئاز به ۲ مول آمونیاک شکسته می شود، آمونیاک افزون بر نیاز باکتری ها، بافری قوی در شکمبه حساب می شود (pKa=9.21) و در pH 6.5 یا کمتر، آمونیاک به آمونیوم تبدیل می شود، اما تنها با خروج آمونیوم، پروتن ها از محیط شکمبه خارج می شوند.
به عبارتی تخمیر پروتئین و NPN باعث تولید آمونیاک شده بر عکس این حالت تخمیر کربوهیدرات ها یا فرآورده هایی مثل سیلاژ باعث افزایش رهاسازی پروتن و کاهش pH شکمبه می شود. غلظت آمونیاک ۲ ساعت بعد از تغذیه افزایش می یابد. این مقدار بواسطه مصرف توسط باکتری ها ( ۳۵ تا ۶۵%)، عبور به هزارلا (۱۰ %) و جذب از شکمبه سریعا کاهش می یابد(Aschenbach et al., 2011). بخشی از آن به صورت آمونیوم به کبد رفته، مورد متابولیسم قرار گرفته و دوباره به صورت اوره از طریق اپتلیال به شکمبه وارد می شود. ورود اوره به شکمبه و خروج آمونیوم بر ساخت پروتئین میکروبی تاثیر می گذارد (شکل ۲). با افزایش غلظت CO2 و SCFA، ورود اوره نیز بیشتر شده ولی با کاهش pH به زیر ۶٫۲ یا افزایش غلظت NH3 نفوذپذیری دیواره شکمبه به اوره کم می شود و ساخت پروتئین میکروبی متوقف می شود، در نتیجه آمونیاک اضافه باید خارج شود و نیتروژن ادرار افزایش می یابد (Dijkstra et al., 2012).
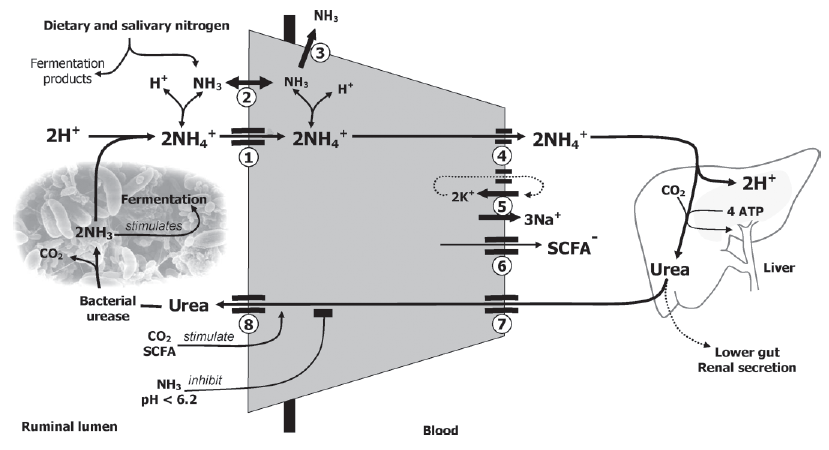 شکل۲٫ مدل انتقال نیتروژن و اثر متقابل آن با SCFA و حالت اسید و باز محیط شکمبه (Aschenbach et al., 2011)
شکل۲٫ مدل انتقال نیتروژن و اثر متقابل آن با SCFA و حالت اسید و باز محیط شکمبه (Aschenbach et al., 2011)
۱ و ۲٫آمونیا اضافه به صورت NH4 از کانال های کاتیونی یا به صورت NH3 جذب می شود، در pH بیش از ۷، فرم NH3 غالب است و در سیتوسل پروتنه شده و مقدار پروتن خروجی از طریق کانال های سدیم –هیدروژنی می کاهد (قسمت ۶ و ۷ در شکل ۱). در pH کمتر ار ۶٫۸ نیز بیشتر به فرم NH4 جذب انجام می شود و در سیتوسل پروتن خود ر رها میکند و به شکل NH3 در می آید(۳) و بار اسیدیته سیتوسل افزایش می یابد. اما فرم NH4 از کانال های مجاور پمپ Na-K,ATPase خارج می شود که بر انتقال پتاسیم تاثیرگذار است (۴ و ۵)، خروج فرم آنیونی SCFA نیز از کانال های پروتئینی انجام می شود(۶) که به حفظ جریان پتاسیم به داخل سیتوسل کمک می کند. اوره تولید از توسط جریان خون وارد سلول اپیتلیال شده و به شکمبه وارد میشود(۷و۸).
pH شکمبه و تجزیه سوبسترا:
ریسک اسیدوز بوسیله افزایش نسبت کنسانتره، به دلیل ذخیره بالای نشاسته و قند در آن افزایش می یابد. باکتری های فیبرولیتیک اصلی، به کاهش pH حساس می باشند و هنگامی که pH شکمبه از حد مشخص افت میکند، تجزیه فیبر سریعا کاهش پیدا می کند. بر خلاف آن، فعالیت و تکثیر باکتری های آمیلولایتیک افزایش می یابد (Erdman, 1988). اما دیده شده باکتری های سلولولایتیک در طول روز مکان هایی از شکمبه که pH پایین است، هنوز فعال بوده و به فعالیت هضم فیبر خود ادامه می دهند (Dijkstra et al., 2012). از سوی دیگر، واریانس بالای pH شکمبه به علت زمان بعد از تغذیه، اندازه ذرات خوراک و مکانی که این ذرات لایه بندی می شوند، زیاد است. مشخص شده تجزیه پذیری فیبر به علت تفاوت در میزان دریافت خوراک و ترکیب جیره تغییر می کند. با این تفاسیر، آیا کاهش pH تنها بر اثر میکروارگانیسم ایجاد میشود یا بر اثر جیره مصرفی؟ جواب را نمیتوان از جنبه تئوری توضیح داد چراکه این دو عامل در هم پیچیده اند و در بسیاری از مقالات همزمان با هم در نظر گرفته شده. راسل (۱۹۹۸) از سیستم تخمیری برون تنی استفاده کرد تا مشخص کند تغییر نسبت استات به پروپیونات در هنگام تغذیه جیره پر کنسانتره ناشی از تغییر pH است یا نوع سوبسترایی که تحت تخمیر قرار میگیرد؟ نتایج نشان داد ۲۵ % تغییرات A:P ناشی از تغییر pH و ۷۵ % از تغییرات نسبت A:P بر اثر نوع جیره تغذیه شده بود و این مفهوم را تائید می کند که بخش اعظم تغییرات A:P که در هنگام SARA رخ می دهد، ناشی از نوع خوراک تغذیه شده است. در مطالعه کالسامجلیا و همکاران (۲۰۰۸) ۲ فرض با استفاده از سیستم کشت پیوسته بررسی شد، فرض صفر که بیان میکرد کاهش pH، دلیل اصلی تغییر الگوی تخمیر در هنگام SARA میباشد و فرض جایگزین بیانگر اثر هر دو عامل کاهش pH و نوع جیره بر تغییرات تخمیر بود. طرح آزمایشی شامل دو نوع جیره با نسبت علوفه به کنسانتره ۶۰ به ۴۰ و جیره دیگر ۱۰ به ۹۰ بود. نتایج نشان داد تغییر در قابلیت هضم ماده آلی، فیبر و نسبت مولار استات اصولا به pH بستگی دارد و تغییر در نسبت مولار پروپیونات و VFA کل، به اثر مرکب pH و نوع جیره بستگی و مقدار نیتروژن آمونیاکی به نوع جیره بستگی دارد(جدول ۲). این نتایج نشان میدهد که تغییر در تخمیر شکمبه بر اثر SARA تنها بر اثر عامل pH نیست ترکیبی از pH و نوع جیره می باشد. بنابراین پیشنهاد شده به جای SARA، عبارت ” high-concentrate syndrome” به کار رود.
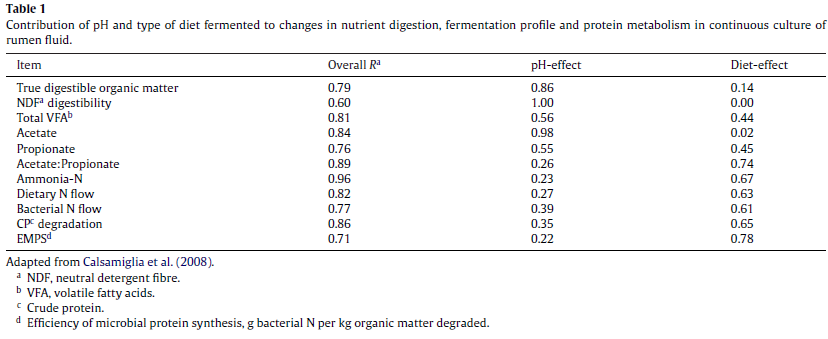 جدول۲٫ سهم pH و نوع جیره تخمیر شده بر پروفایل VFA و دیگر پارامترهای شکمبه ای (Calsamiglia et al., 2008)
جدول۲٫ سهم pH و نوع جیره تخمیر شده بر پروفایل VFA و دیگر پارامترهای شکمبه ای (Calsamiglia et al., 2008)
در سیستم های ارزیابی خوراک، نسبت به اثر متقابل بین اجزای خوراک بی توجه بوده و تنها به ارزش ثابت آنها بسنده می شود. جدول ۳ اهمیت این موضوع را نشان می دهد. کاهش در تجزیه فیبر، میزان VFA تولیدی را کاهش میدهد. به خاطر اینکه VFA منبع اصلی انرژی برای نشخوارکنندگان است، انرژی خالص خوراک (به صورت تئوری پیش بینی شده) کمتر از مقدار مورد انتظار خواهد بود. در ادامه پروتئین جذبی از روده نیز کاهش خواهد یافت. اینها همه در ضررهای اقتصادی وارد شده به دامدار نقش داشته و نشان می دهد بهبود تجزیه فیبر در pH پایین، می تواند ذخایر پروتئین میکروبی، تولید VFA های مورد نظر و در نهایت ارزش انرژی و پروتئین خوراک را بهبود ببخشد.
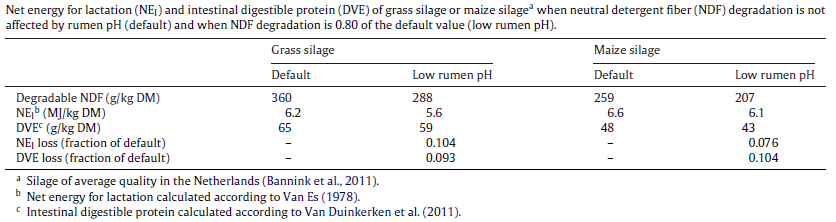 جدول ۳٫ انرژی خالص برای شیردهی (NEL) و پروتئین قابل هضم روده ای (DVE) از سیلوی ذرت و سیلوی گراس، وقتی که تجزیه NDF تحت تاثیر pH نیست و وقتی که تجزیه NDF (تحت pH پایین)، ۰٫۸ حالت قبل است (Dijkstra et al., 2012)
جدول ۳٫ انرژی خالص برای شیردهی (NEL) و پروتئین قابل هضم روده ای (DVE) از سیلوی ذرت و سیلوی گراس، وقتی که تجزیه NDF تحت تاثیر pH نیست و وقتی که تجزیه NDF (تحت pH پایین)، ۰٫۸ حالت قبل است (Dijkstra et al., 2012)
در رابطه با همین مباحث سوال دیگری پیش می آید. آیا تنها pH شکمبه موجب کاهش چربی شیر می شود؟ اسیدهای چرب ترانس و کانژوگیت لینولئیک اسید از مهمترین واسطه های بیوهیدروژناسیون اسید های چرب غیر اشباع در شکمبه هستند. از میان انواع ترانس دو ایزومر trans-10 C18: و trans-11 C18: بیشتر مورد توجه است. در بسیاری از شرایط trans-11 ایزومر عمده بر اثر بیوهیدورژنه شدن لینونئیک و لینولنیک اسید است. trans-11 به عنوان سوبسترای اصلی تولید CLA بر اثر آنزیم Δ۹ desaturase است که نهایتا چربی شیر را تامین میکند. اما در برخی شرایط مثل اسیدوز و جیره های پرکنسانتره موجب میشود باکتری های تولید کننده CLA cis-12,trans-10 افزایش یابد که موجب افزایش میزان trans-10 می شود و نهایتا عاملی است برای کاهش چربی شیر(AbuGhazaleh et al.,2005).
در مطالعه کلمن (۲۰۱۰) برای بررسی اثر SARA بر پروفایل اسیدهای چرب، ۶ هفته گاوها تحت SARA قرار گرفتند. اسید های چرب فردکربنه و منشعب (OBCFA) و C18:1 trans-10 با افزایش مقدار کنسانتره، افزایش یافت در حالی که C18:1 trans-11 (واسنیک اسید) کاهش داشت. وجود یا کمبود برخی اسید های چرب مثل iso C13:0, iso C16:0, and C18:2 cis-9,trans-11 می تواند به عنوان متغیر هایی برای پی بردن به اسیدوز باشد چرا که در ارتباط با الگوهای تخمیری شکمبه میباشند. رابطه همبستگی مثبت بین نسبت استات با اسیدهای چربiso C14:0 و iso C15:0 و نیز بین نسبت پروپیونات با C15:0, C17:0 در چربی شیر موجود است اما تغییر ناگهانی در جمعیت میکروبی این روابط را بر هم میزند و میتوان به این صورت گفت که تغییر در OBCFA شکمبه وابسته به پیش سازها نیست (مثلا پروپیونات برای C15:0, C17:0) بلکه بوسیله جمعیت میکروبی تعیین می شود (Colman et al.,2010). در این مطالعه علاوه بر pH، به اهمیت دیگر عوامل مثل جمعیت میکروبی تاکید می شود. نکته دیگر علاوه بر عامل pH، در رابطه با سوبسترای در دسترس میکروب ها است که در مطالعه ابوغزاله و همکاران (۲۰۰۵) در این باره تحقیقی انجام گرفت که در آن مطالعه، اولئیک اسید به عنوان سوبسترا در نظر گرفته شد. شکل ۵ نشان میدهد غلظت trans-10 در هر دو pH 5.5 و ۶٫۵ بالاتر از دیگر غلظت های انواع اسیدهای چرب ترانس میباشد. به عبارتی تولید trans-10 در pH 6.5 هم بیشتر از دیگر اسیدهای چرب بوده که ممکن است نشاندهنده این باشد که تنها کاهش pH منجر به تولیدtrans-10 نمیشود بلکه ممکن است سوبسترا در دسترس که در این آزمایش اولئیک اسید بود باعث افزایش trans-10 شده باشد و یا بر عکس، trans-11 اسید چرب واسطه غالب در بیوهیدروژنه شدن اولئیک اسید نیست (AbuGhazaleh et al.,2005).
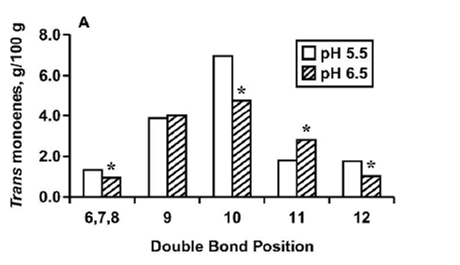 شکل۵٫ غلظت اسیدهای چرب ترانس حاصل از اولئیک اسید با توجه به pH شکمبه در شرایط برون تنی(AbuGhazaleh et al.,2005)
شکل۵٫ غلظت اسیدهای چرب ترانس حاصل از اولئیک اسید با توجه به pH شکمبه در شرایط برون تنی(AbuGhazaleh et al.,2005)
راه های بهبود pH شکمبه:
بافری کردن محیط شکمبه :
بیکربنات سال هاست به عنوان رایج ترین عامل بافری شکمبه شناخته شده است. سیستم بافری بیکربنات فرآیند پیچیده ای دارد به دلیل اینکه تنها به فرم فرم پروتنه خود (اسید کربونیک) وابسته نیست، به عنوان مثال عوامل دیگر همچون فشار گاز CO2 در بهبود عملکرد بیکربنات نقش ویژه ای دارد (شکل۱). بیکربنات بوسیله بزاق یا دیواره شکمبه به محیط شکمبه وارد می شود. سیستم بافری بزاق با اینکه می تواند به خوبی بار اسیدی را خنثی کند اما به دلیل ترشح کمتر نسبت به شدت اسیدی شدن شکمبه در مقابله با SARA توان کمتری دارد اما سیستم کارامد تر دیگر، دیواره شکمبه میباشد که مقدار بیکربنات بیشتر تولید کرده و نیز میتواند بافر های پروتنه شده با pKa پایین را جذب کند. محاسبات تئوری راجع به ترشح بیکربنات از بزاق نشان داده در جیره های با سطح کنسانتره بالا، این مقدار ترشح، نصف مقداری است که از دیواره شکمبه ترشح می شود (جدول ۳). البته تنها نباید تمرکز خود را بر بیکربنات جلب کرد چراکه موارد دیگر مثل ظرفیت بافری خوراک نیز می تواند در مقادیر pH تغییر ایجاد کند (Dijkstra et al., 2012). با این حال پاسخ بیکربنات تولیدی در گاوهای پرتولید با مصرف کنسانتره بالا جوابگوی تغییرات pH نیست. به همین دلیل استفاده از بافر های اگزوژنوس توصیه می شود. بیش از ۴۰ سال است که از سدیم بیکربنات (SB) برای تعدیل pH شکمبه و جلوگیری از کاهش چربی شیر درجیره استفاده میشود.
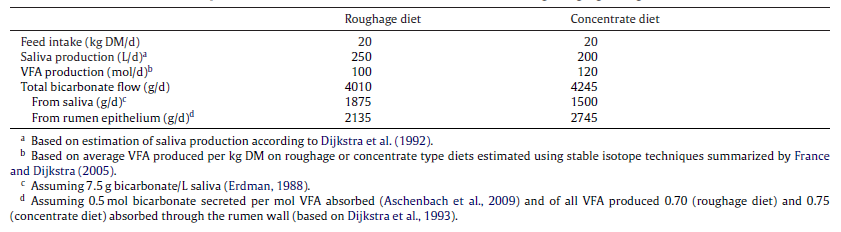 جدول۴٫ سهم تولیدی بیکربنات از دو منبع بزاق و اپیتلیوم شکمبه در دو جیره متفاوت (Dijkstra et al., 2012)
جدول۴٫ سهم تولیدی بیکربنات از دو منبع بزاق و اپیتلیوم شکمبه در دو جیره متفاوت (Dijkstra et al., 2012)
در کل میتوان اثر SB را در اوایل و میانه دوره شیردهی به این صورت خلاصه کرد: افزایش DMI (0.5 تا ۱٫۲۴ Kg/d)، pH شکمبه(۰٫۰۷ تا ۰٫۱۳ واحد)، مقدار چربی شیر (۱٫۶ تا ۲٫۷g/kg milk) و نسبت A:P(0.26 تا ۰٫۳) (Erdman, 1988; Hu and Murphy, 2005). افزودن سدیم بیکربنات شرایط خاص خود را دارد مثل استفاده در اوایل و میانه شیردهی، بیش از ۵۰ % کنسانتره در جیره و منبع علوفه ای منحصرا سیلاژ ذرت باشد. سدیم سسکویی کربنات (SSC) شامل (NaHCO3·Na2CO3·۲H2O) می باشد که پتانسیل خوبی در خنثی نمودن اسید دارد و موجب افزایش FCM 4% میشود اما تاثیر آن بر مصرف خوراک، تولید شیر، وترکیب شیر بسته به ترکیب جیره، مرحله شیردهی و منبع تجاری آن متفاوت است (Ghorbani et al., 1989). MgO یک الکالایزر است که می تواند اسید را در جهت بهبود pH شکمبه خنثی کند و اثر آن آهسته و تقریبا ۲۴ ساعت بعد از تیمار آن اعمال میشود، از مشکلات آن کاهش خوشخوراکی جیره است (Erdman, 1988). بافر های متنوع دیگر با نام های تجاری مختلف بکار می روند که از حوصله این بحث خارج است.
کاهش تولید اسید لاکتیک در شکمبه :
کنترل تولید اسید لاکتیک در شکمبه از طریق کنترل جمعیت میکروبی مشکل می باشد. برخی آنتی بیوتیک ها مانند موننسین با اینکه بر علیه سویه های خاصی تولید شدند اما هنوز بر طیف گسترده ای از جمعیت میکروبی اثر گذاشته و از طرفی استفاده از آنتی بیوتیک های ممانعت کننده رشد در اتحادیه اروپا منع شده. شو و همکاران (۲۰۰۰) فرضیه ای مطرح نمودند که اگر گاو را با آنتی ژن های بر علیه باکتری های شکمبه ایمن سازیم، ایمنوگلوبولین ها از بزاق به شکمبه منتقل شده و عمل این باکتری ها را خنثی میکند. همانطوری که واکسن های S. bovis و Lactobacillus ساخته شد و در روزهای بخصوص به گاو تزریق می شود. نتایج نشان داد سطوح آنتی بادی بر علیه S. bovis و Lactobacillus در سرم خون و بزاق بالاتر رفته و شمار این باکتری ها و لاکتات شکمبه کاهش یافت (Shu et al., 2000). مشابه همین ایده دی لورنزو و همکاران (۲۰۰۶) آنتی بادی های پلی کلونال بر علیه S. bovis و Fusobacterium necrophorum (تاثیر بر تولید VFA) به ترتیب PAP-Sb و PAP-Fn در استیر بکار برد و نتایج مثبتی در رابطه با کاهش جمعیت آنها مشابه با بکار بردن یونوفرها و افزایش pH مشاهده نمود. ضمن اینکه آنتی بادی های پلی کلونال بر علیه فوزوباکتریوم تاثیری بر S. bovis و pH نداشت. بلنچ و همکاران (۲۰۰۹) اثر آنتی بادی های پلی کلونال چند ظرفیتی (multivalent Polyclonal Antibody Preparation) را بر علیه چندین آنتی ژن و میکروارگانیسم های شکمبه (تیمار PAP) بر الگوهای تخمیر، در طول القای SARA بررسی کرد. پروتکل القای اسیدوز شامل ۳ دوره بود ۱٫ سه ماه تغذیه بر پایه علوفه کاه در حد اشتها ۲٫ ۱۰ روز ابتدای آزمایش عادت پذیری (جیره علوفه ای به همراه PAP) 3. روز ۱۱ تا ۱۵ افزایش روزانه ۲٫۵ کیلوگرم کنسانتره تا اینکه به ۱۲٫۵ کیلوگرم برسد همراه با علوفه کاه در حد اشتها. گروه های تیمار روزانه PAP دریافت میکردند. در تلیسه زمانی اسیدوز القا شده بود که در مقایسه با روزهای قبل pH شکمبه به زیر ۵٫۵ واحد یا مصرف ماده خشک به کمتر از ۵۰ % برسد. در پایان آزمایش، اسیدوز در ۸۳٫۳ % از گروه کنترل و ۵۰ % از تیمار PAP ، به طور موفقیت آمیز القا شده بود. نتایج نشان داد در طول آزمایش تیمار های PAP، pH شکمبه بالاتری نسبت به گروه شاهد داشتند. در برخی نقاط کاهش pH مربوط به غلظت بالاتر VFAدر تیمار های PAP میباشد (شکل ۳). مقدار DNA باکتری های تولید کننده لاکتات در گروه شاهد بیشتر بود اما با تیمار PAP به علت واریانس زیاد بین حیوانات تفاوت معنی دار نداشت. در هر حال با واکسیناسیون علیه S.Bovis میتوان ریسک SARA را کاهش داد، همچنین محققان را در جهت تغییر جمعیت باکتری های خاص در رابطه با اعمال اختصاصی مثل تجزیه کنندهای پروتئین، فیبر و … تشویق میکند، به طوری که عصاره های گیاهی و فراورده های فرعی گیاهی با اثرات آنتی میکروبیال به عنوان جایگزین های طبیعی به جای آنتی بیوتیک ها، در تغذیه حیوانات پیشنهاد شده (Calsamiglia et al., 2012).
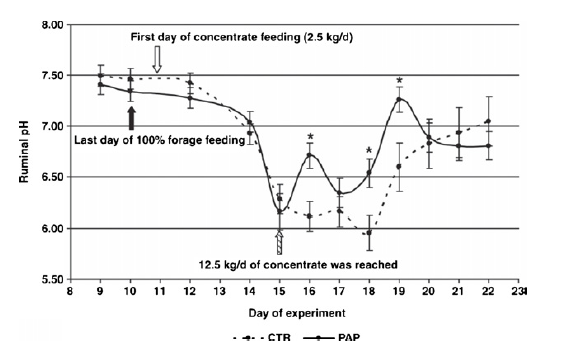 شکل ۳٫ تاثیر تغذیه آنتی بادی های پلی کلونال در طول تحریک SARA. ستاره ها نشان دهنده تفاوت میان شاهد و PAP می باشد (Blanch et al., 2009).
شکل ۳٫ تاثیر تغذیه آنتی بادی های پلی کلونال در طول تحریک SARA. ستاره ها نشان دهنده تفاوت میان شاهد و PAP می باشد (Blanch et al., 2009).
بهبود مصرف لاکتیک اسید:
چندین راهکار در این باره موجود است از جمله تغذیه مستقیم میکروب، مخمر یا قارچ و اسید مالیک.
مخمر و قارچ با تغییر الگوهای تخمیری خوراک در شکمبه اثر غیر مستقیم بر pH دارند. ساکارومایسز سرویزیه می تواند جمعیت باکتری های Megasphaera elsdenii و Selenomonas ruminantium را افزایش داده و موجب مصرف بیشتر اسید لاکتیک شود، افزودن ساکارومایسز سرویزیه به جیره، باعث افزایش باکتری های بی هوازی و قارچ های سلولولایتیک (خصوصا Fibrobacter succinogenes, Ruminococcus albus, Neocallimastix frontalis) هم در مطالعات درون تنی هم برون تنی شده و نیز با S.Bovis بر سر گلوکز رقابت کرده و قابلیت دسترسی گلوکز و تولید اسید لاکتیک در محیط را کاهش داده (Callaway and Martin, 1997). مشخص شده تکثیر S. ruminantium بوسیله برخی مواد مغذی مثل اسید های آلی (مالات و فومارات) و نیز بوسیله افزودن مواد فیلتر شده از کشت مخمر افزایش یافته (Callaway and Martin, 1997). Aspergillus oryzae نیز مکانیسم شبیه ساکارومایسز دارد.
در مطالعه ماردن و همکاران (۲۰۰۸) اثر مخمر ساکارومایسز سرویزیه با سدیم بیکربنات بر تعدیل pH مقایسه شد، او گزارش کرد هر دو SB و مخمر اثرات متعادل کننده یکسان بر pH شکمبه دارند با این تفاوت که مخمر از تجمع لاکتات (عامل اسیدوز حاد) جلوگیری کرده و قابلیت هضم فیبر جیره را بوسیله افزایش باکتری های سلولولایتیک افزایش داده است.
راه ساده تر افزودن خود باکتری های مصرف کننده اسید لاکتیک به جیره می باشد. در رابطه با افزودن میکروارگانیسم های زنده مثل S. ruminantium spp. lactilytica و M. elsdenii در جیره گوسفند و گاوهای گوشتی نتایج مثبتی بدست آمده (Calsamiglia et al., 2012). کونگ و هشن (۱۹۹۵) گزارش کردند تلقیح M. elsdenii در محیط کشت برون تنی مایع شکمبه همراه با مواد سریع التخمیر موجب جلوگیری از افت pH بعد از تغذیه و کاهش غلظت اسید لاکتیک می شود. باکتری های مصرف کننده لاکتیک در صورتی که سوبسترای اصلی شان یعنی اسید لاکتیک بیشتر در دسترس شان باشد بیشتر تحریک به تکثیر می شوند. به همین صورت برخی باکتری های تولید کننده اسید لاکتیک در جلوگیری از اسیدوز موثرند. برخی محققان این باکتری ها را همراه با مخمر بکار بردند. بر اثر بکاربردن ترکیبی از Enterococcus faecium و Lactobacillus plantarum در جیره گاوهای شیری، pH حداقل و ناحیه زیر منحنی pH 5.5 کمتری گزارش شد. البته هنوز مکانیسم دقیق آن مشخص نیست اما با افزایش سوبسترا میکروارگانیسم ها عادت پذیری سریعتری برای مصرف سوبسترا داشتند (Calsamiglia et al., 2012).
از افزودنی های دیگر برای کنترل SARA ، مالیک اسید می باشد. آشکار است با افزودن یک اسید نمی توان افزایش pH را انتظار داشت اما نقش آن به همراه دیگر اسید های آلی (آسپاراتیک و فوماریک اسید) در تحریک باکتری های مصرف کننده لاکتیک اسید است. S. ruminantium از لاکتات برای تولید انرژی استفاده و تولید پروپیونات می کند. اسید های آلی موجب تحریک تکثیر S. ruminantium می شود چرا که این اسید ها، بر کمبود اگزالواستات ناشی از گلوکونئوژنسیس غلبه دارند. تامین اگزالواستات بوسیله متابولیزه کردن فومارات و مالات یا بوسیله ذخیره کردن آن به آسپارتات انجام می شود. مصرف لاکتات توسط S. ruminantium بوسیله تیمار های آسپاراتات و فومارات تا ۴ برابر و توسط مالات تا ۱۰ برابر افزایش یافته و میزان رشد آن بوسیله محلول mM 10 از ال-آسپاراتات، فومارات یا ال-مالات به اندازه ۲ برابر افزایش یافته. در هر حال کاهش غلظت لاکتات به تنهایی سبب افزایش pH شکمبه نمی شود. مشاهده کردند که اسید های آلی تولید CO2 را در طی مکانیسم های بافری افزایش داده که منجر به بهبود اثر بافری و افزایش pH شکمبه شدند و CO2 اضافی از راه دهان خارج شده (Calsamiglia et al., 2012). مارتین و همکاران (۱۹۹۹) در مطالعاتی مجزا اثر ۳ دوز از مالات (۲۷، ۵۴ و ۸۰ گرم در روز) را بر گاوهای تغذیه شده با جیره حاوی ۷۰ تا ۸۰ درصد دانه ذرت غلتک خورده به همراه لازالوسید بررسی نمود (شکل ۴) نتایج نشان داد مالات تاثیر مثبتی در جلوگیری از افت pH در ۱ تا ۲ ساعت بعد از مصرف خوراک در جیره های پرکنسانتره دارد. در مقابل مالات اثری بر مقدار لاکتات، پروپیونات و نسبت A:P نداشته. در آزمایشی دیگر بر گاوهای شیری مشاهده شد افزودن ۵۰ گرم مالات در روز باعث افزایش تولید شیر، پروتئین و لاکتوز خواهد شد (Sniffen et al., 2006)، اما در مقابل تعدادی از محققین نیز اثر مثبتی از مالات نگرفتند.
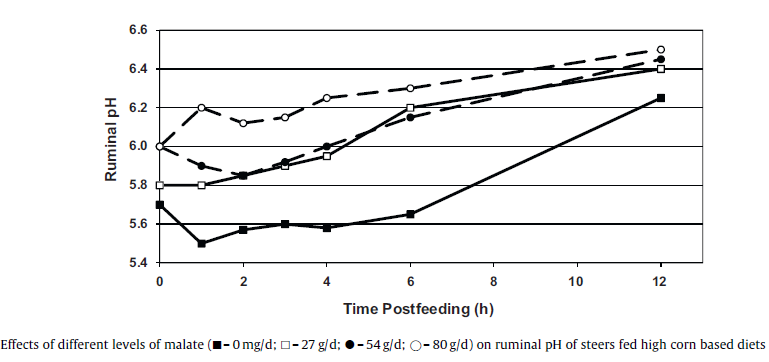 شکل ۴٫ تاثیر سطوح مختلف مالات (g/d صفر: ■، ۲۷: □، ۵۴: ● و ۸۰: ○) بر pH شکمبه استیرهای تغذیه شده با مقادیر بالای ذرت (Martin et al.,1999).
شکل ۴٫ تاثیر سطوح مختلف مالات (g/d صفر: ■، ۲۷: □، ۵۴: ● و ۸۰: ○) بر pH شکمبه استیرهای تغذیه شده با مقادیر بالای ذرت (Martin et al.,1999).
تألیف: سید دانیال دانشور
منابع:
AbuGhazaleh, A. A., M. B. Riley, E. E. Thies, and T. C. Jenkins.2005. Dilution rate and pH effects on the conversion of oleic acid to trans C18:1 Positional Isomers in Continuous Culture. J. Dairy Sci. 88:4334–۴۳۴۱٫
Aschenbach, J. R., G. B. Penner, F. Stumpff and G. Gäbel.2011.Ruminant nutrition symposium: Role of fermentation acid absorption in the regulation of ruminal pH. J. Anim. Sci. 89:1092–۱۱۰۷٫
Blanch, M., S. Calsamiglia, N. DiLorenzo, N. DiCostanzo, S. Muetzel, and R.J. Wallace.2009.Physiological changes in rumen fermentation during acidosis induction and its control using a multivalent polyclonal antibody preparation in heifers. J. Anim. Sci. 87:1722-1730.
Calsamiglia, S., M. Blanch, A. Ferret, and D. Moya.2012. Is subacute ruminal acidosis a pH related problem? Causes and tools for its control. Anim Feed Sci and Technol.172:42– ۵۰٫
Calsamiglia, S., P. W. Cardozo., A. Ferret, and A. Bach. 2008. Changes in rumen microbial fermentation are due to a combined effect of type of diet and pH. J.Anim. Sci. 86, 702–۷۱۱٫
Callaway, E.S., S.A. Martin. 1997. Effects of a Saccharomyces cerevisiae culture on ruminal bacteria that utilize lactate and digest cellulose. J. Dairy Sci. 80: 2035–۲۰۴۴٫
Colman, E., W. B. Fokkink, M. Craninx, J. R. Newbold, B. De Baets, and V. Fievez.2010. Effect of induction of subacute ruminal acidosis on milk fat profile and rumen parameters. J. Dairy Sci.93:4759–۴۷۷۳٫
Dijkstra, J., J. L. Ellis, E. Kebreab, A. B. Strathe, S. López, J. France, and A. Bannink.2012. Ruminal pH regulation and nutritional consequences of low pH. Anim Feed Sci and Technol.172:22– ۳۳٫
DiLorenzo, N., F. Diez-Gonzalez, A. DiCostanzo. 2006. Effects of feeding polyclonal antibody preparations on ruminal bacterial populations and ruminal pH of steers fed high-grain diets. J. Anim. Sci. 84: 2178–۲۱۸۵٫
Erdman, R.A., 1988. Dietary buffering requirements of the lactating dairy cow: a review. J. Dairy Sci. 71: 3246–۳۲۶۶٫
Ghorbani, G.R., J. A. Jackson, R. W. Hemken. 1989. Effects of sodium bicarbonate and sodium sesquicarbonate on animal performance, ruminal metabolism, and systemic acid-base status. J. Dairy Sci. 72: 2039–۲۰۴۵٫
Ghorbani, G.R., D. P. Morgavi, K. A. Beauchemin, J. A. Z. Leedle. 2002. Effects of direct-fed microbials on rumen fermentation, blood variables, and the microbial populations of feedlot cattle. J. Anim. Sci. 80: 1977–۱۹۸۵٫
Hu, W., M. R. Murphy. 2005. Statistical evaluation of early or mid-lactation dairy cow responses to dietary sodium bicarbonate addition. Anim. Feed Sci.
Technol. 119: 43–۵۴٫
Kleen, J.L., G. A. Hooijer, J. Rehage, J. P. Noordhuizen. 2009. Subacute ruminal acidosis in Dutch dairy herds. Vet. Rec. 164: 681–۶۸۴٫
Kung, L., A. O.Hession. 1995. Preventing in vitro lactate accumulation in ruminal fermentations by inoculation with Megasphaera elsdenii. J. Anim. Sci. 73: 250–۲۵۶٫
Loncke, C., I. Ortigues-Marty, J. Vernet, H. Lapierre, D. Sauvant, and P. Nozier.2009. Empirical prediction of net portal appearance of volatile fatty acids, glucose, and their secondary metabolites(β-hydroxybutyrate, lactate) from dietary characteristicsin ruminants: A meta-analysis approach. J. Anim. Sci.87:253–۲۶۸٫
Marden, J.P., C. Julien, V. Monteils, E. Auclair, R. Moncoulon, and C. Bayourthe. 2008. How does live yeast differ from sodium bicarbonate to stabilize ruminal pH in high-yielding dairy cows? J. Dairy Sci. 91, 3528–۳۵۳۵٫
Martin, S.A., Streeter, M.N., Nisbet, D.J., Hill, G.M., Williams, S.E., 1999. Effects of dl-Malate on ruminal metabolism and performance of cattle fed a highconcentrate
diet. J. Anim. Sci. 77, 1008–۱۰۱۵٫
Nocek, J. E. 1997. Bovine acidosis: implications on laminitis. J. Dairy Sci. 80, 1005–۱۰۲۸٫
Sato, S., A. Ikeda, Y. Tsuchiya, K. Ikuta, I, Murayama, M. Kanehira, and Keiji Okada.2012. Diagnosis of subacute ruminal acidosis (SARA) by continuous reticular pH measurements in cows.Vet Res Commun 36:201–۲۰۵٫
Shu, Q., H. S. Gill, R. A. Leng, and J. B. Rowe. 2000. Immunization with Streptococcus bovis vaccine administered by different routes against lactic acidosis in sheep. Vet. J. 159: 262–۲۶۹٫
Sniffen, C. J., C. S. Ballard, M. P. Carter, K. W. Cotanch, H. M. Danna, R. J Grant, P. Mandebvu, M. Suekawa, and S. A. Martin. 2006. Effects of malic acid on microbial efficiency and metabolism in continuous culture of rumen contents and on performance of mid-lactation dairy cows. Anim. Feed Sci. Technol. 127: 13–۳۱٫
Reynolds, C. K., N. B.Kristensen. 2008. Nitrogen recycling through the gut and the nitrogen economy of ruminants: an asynchronous symbiosis. J. Anim. Sci.86: 293–۳۰۵٫
Russell, J. B.1998. The importance of pH in the regulation of ruminal acetate to propionate ratio and methane production in vitro . J. Dairy Sci. 81:3222–۳۲۳۰٫
Zebeli, Q., J. Dijkstra, M. Tafaj, H. Steingass, B. N. Ametaj, W. Drochner. 2008. Modeling the adequacy of dietary fiber in dairy cows based on the responses of ruminal pH and milk fat production to composition of the diet. J. Dairy Sci. 91: 2046–۲۰۶۶٫